Die Wärmekapazität eines Gases ist die Energiemenge, die ein Körper aufnimmt, wenn er um ein Grad erwärmt wird. Analysieren wir die Hauptmerkmale dieser physikalischen Größe.

Definitionen
Die spezifische Wärme eines Gases ist die Einheitsmasse einer bestimmten Substanz. Seine Maßeinheiten sind J/(kg·K). Die Wärmemenge, die der Körper bei der Änderung seines Aggregatzustands aufnimmt, hängt nicht nur mit dem Anfangs- und Endzustand zusammen, sondern auch mit der Art des Übergangs.

Abteilung
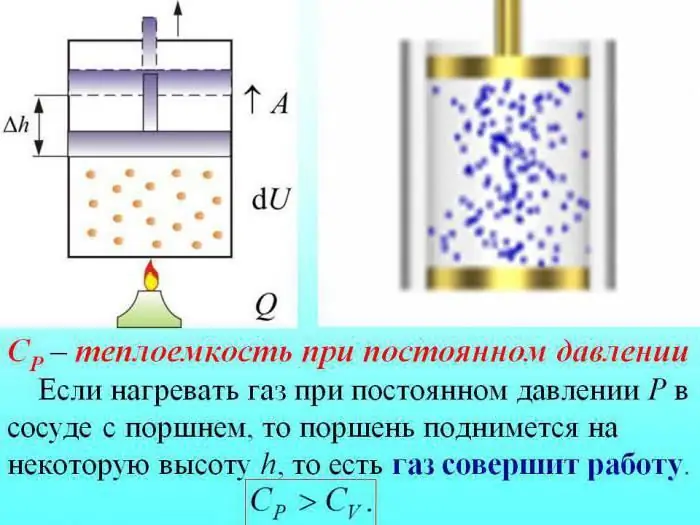
Die Wärmekapazität von Gasen wird dividiert durch den bei konstantem Volumen (Cv), konstantem Druck (Cр) ermittelten Wert.
Beim Erhitzen ohne Druckänderung wird etwas Wärme verbraucht, um die Arbeit der Gasausdehnung zu leisten, und ein Teil der Energie wird verbraucht, um die innere Energie zu erhöhen.
Die Wärmekapazität von Gasen bei konstantem Druck wird durch die Wärmemenge bestimmt, die zur Erhöhung der inneren Energie aufgewendet wird.
Gaszustand: Eigenschaften, Beschreibung
Die Wärmekapazität eines idealen Gases wird unter Berücksichtigung der Tatsache bestimmt, dass Сp-Сv=R. Letztere Größe wird als universelle Gaskonstante bezeichnet. Sein Wert entspricht 8,314 J/(mol K).
Bei theoretischen Berechnungen der Wärmekapazität, beispielsweise zur Beschreibung des Zusammenhangs mit der Temperatur, reicht es nicht aus, nur thermodynamische Methoden zu verwenden, es ist wichtig, sich mit Elementen der statischen Physik auszurüsten.
Die Wärmekapazität von Gasen beinh altet die Berechnung des Mittelwerts der Energie der Translationsbewegung einiger Moleküle. Eine solche Bewegung wird aus der Rotations- und Translationsbewegung des Moleküls sowie aus den inneren Schwingungen der Atome zusammengefasst.
In der statischen Physik gibt es Informationen, dass es für jeden Freiheitsgrad der Rotations- und Translationsbewegung eine Größe für ein Gas gibt, die gleich der Hälfte der universellen Gaskonstante ist.

Interessante Fakten
Ein Teilchen eines einatomigen Gases hat drei Translationsfreiheitsgrade, also hat die spezifische Wärme eines Gases drei Translations-, zwei Rotations- und einen Vibrationsfreiheitsgrad. Das Gesetz ihrer gleichmäßigen Verteilung führt dazu, dass die spezifische Wärme bei konstantem Volumen mit R.
gleichgesetzt wird.
Während der Experimente wurde festgestellt, dass die Wärmekapazität eines zweiatomigen Gases dem Wert R entspricht. Eine solche Diskrepanz zwischen Theorie und Praxis erklärt sich dadurch, dass die Wärmekapazität eines idealen Gases mit Quanten verbunden ist Effekte, daher ist es wichtig, bei Berechnungen Statistiken zu verwenden, die auf Quanten basierenMechanik.
Basierend auf den Grundlagen der Quantenmechanik hat jedes System von Teilchen, die oszillieren oder rotieren, einschließlich Gasmolekülen, nur einige diskrete Energiewerte.
Wenn die Energie der thermischen Bewegung im System nicht ausreicht, um Schwingungen einer bestimmten Frequenz anzuregen, tragen solche Bewegungen nicht zur Gesamtwärmekapazität des Systems bei.
Dadurch wird ein bestimmter Freiheitsgrad "eingefroren", es ist unmöglich, das Gleichteilungsgesetz darauf anzuwenden.
Die Wärmekapazität von Gasen ist eine wichtige Eigenschaft des Zustands, von der das Funktionieren des gesamten thermodynamischen Systems abhängt.
Die Temperatur, bei der das Gleichverteilungsgesetz auf den Schwingungs- oder Rotationsfreiheitsgrad angewendet werden kann, wird von der Quantentheorie charakterisiert, verbindet die Planck-Konstante mit der Boltzmann-Konstante.

Diatomeengase
Die Abstände zwischen den Rotationsenergieniveaus solcher Gase betragen nur wenige Grad. Die Ausnahme ist Wasserstoff, bei dem der Temperaturwert durch Hunderte von Grad bestimmt wird.
Deshalb lässt sich die Wärmekapazität eines Gases bei konstantem Druck nur schwer durch das Gesetz der Gleichverteilung beschreiben. In der Quantenstatistik wird bei der Bestimmung der Wärmekapazität berücksichtigt, dass ihr Schwingungsanteil bei einer Temperaturabnahme schnell abnimmt und Null erreicht.
Dieses Phänomen erklärt die Tatsache, dass bei Raumtemperatur praktisch kein Schwingungsanteil der Wärmekapazität vorhanden ist, zzweiatomiges Gas, es entspricht der Konstante R.
Die Wärmekapazität eines Gases bei konstantem Volumen wird bei Tieftemperaturindikatoren mit Hilfe der Quantenstatistik bestimmt. Es gibt das Nernst-Prinzip, das als dritter Hauptsatz der Thermodynamik bezeichnet wird. Aufgrund seiner Formulierung nimmt die molare Wärmekapazität eines Gases mit sinkender Temperatur ab und geht gegen Null.

Eigenschaften von Festkörpern
Wenn die Wärmekapazität eines Gasgemisches quantenstatistisch erklärt werden kann, dann ist für einen festen Aggregatzustand die thermische Bewegung durch leichte Schwankungen der Teilchen nahe der Gleichgewichtslage gekennzeichnet.
Jedes Atom hat drei Schwingungsfreiheitsgrade, daher kann gemäß dem Gleichverteilungsgesetz die molare Wärmekapazität eines Festkörpers als 3nR berechnet werden, wobei n die Anzahl der Atome in einem Molekül ist.
In der Praxis ist diese Zahl die Grenze, zu der die Wärmekapazität eines Festkörpers bei hohen Temperaturen tendiert.
Für einige Elemente, einschließlich Metalle, kann bei normalen Temperaturen ein Maximum erreicht werden. Für n=1 ist das Gesetz von Dulong und Petit erfüllt, aber für komplexe Substanzen ist es ziemlich schwierig, eine solche Grenze zu erreichen. Da der Grenzwert in der Realität nicht erreicht werden kann, kommt es zur Zersetzung oder zum Schmelzen des Feststoffs.
Geschichte der Quantentheorie
Die Begründer der Quantentheorie sind Einstein und Debye zu Beginn des zwanzigsten Jahrhunderts. Es basiert auf der Quantisierung von Schwingungsbewegungen von Atomen in einem bestimmtenKristall. Bei Tieftemperaturindikatoren stellt sich heraus, dass die Wärmekapazität eines Festkörpers direkt proportional zum Kubikwert ist. Diese Beziehung wurde als Gesetz von Debye bezeichnet. Als Kriterium, das es ermöglicht, zwischen niedrigen und hohen Temperaturindikatoren zu unterscheiden, wird deren Vergleich mit der Debye-Temperatur genommen.
Dieser Wert wird durch das Schwingungsspektrum eines Atoms im Körper bestimmt und hängt daher stark von den Eigenschaften seiner Kristallstruktur ab.
QD ist ein Wert, der mehrere hundert K hat, aber zum Beispiel bei Diamant viel höher ist.
Die Leitungselektronen tragen wesentlich zur Wärmekapazität von Metallen bei. Zur Berechnung wird die Fermi-Quantenstatistik verwendet. Die elektronische Leitfähigkeit für Metallatome ist direkt proportional zur absoluten Temperatur. Da es sich um einen unbedeutenden Wert handelt, wird er nur bei Temperaturen gegen den absoluten Nullpunkt berücksichtigt.
Methoden zur Bestimmung der Wärmekapazität
Die wichtigste experimentelle Methode ist die Kalorimetrie. Um eine theoretische Berechnung der Wärmekapazität durchzuführen, wird die statistische Thermodynamik verwendet. Sie gilt sowohl für ein ideales Gas als auch für kristalline Körper und wird anhand experimenteller Daten zum Aufbau der Materie durchgeführt.
Empirische Methoden zur Berechnung der Wärmekapazität eines idealen Gases basieren auf der Idee der chemischen Struktur, dem Beitrag einzelner Atomgruppen zu Ср.
Für Flüssigkeiten werden auch Methoden verwendet, die auf der Nutzung der Thermodynamik beruhenZyklen, die den Übergang von der Wärmekapazität eines idealen Gases zu einer Flüssigkeit durch die Ableitung der Temperatur von der Enthalpie des Verdampfungsprozesses ermöglichen.
Bei einer Lösung ist die Berechnung der Wärmekapazität als additive Funktion nicht erlaubt, da der Überschuss der Wärmekapazität der Lösung grundsätzlich signifikant ist.
Zur Auswertung benötigen wir die molekularstatistische Lösungstheorie. Am schwierigsten ist die Bestimmung der Wärmekapazität heterogener Systeme in der thermodynamischen Analyse.

Schlussfolgerung
Die Untersuchung der Wärmekapazität ermöglicht es Ihnen, die Energiebilanz von Prozessen zu berechnen, die in chemischen Reaktoren sowie in anderen chemischen Produktionsanlagen ablaufen. Außerdem ist dieser Wert für die Auswahl optimaler Kühlmittelsorten notwendig.
Derzeit ist die experimentelle Bestimmung der Wärmekapazität von Stoffen für verschiedene Temperaturintervalle - von niedrigen Werten bis zu hohen Werten - die Hauptoption zur Bestimmung der thermodynamischen Eigenschaften eines Stoffes. Bei der Berechnung der Entropie und Enthalpie eines Stoffes werden Wärmekapazitätsintegrale verwendet. Informationen über die Wärmekapazität chemischer Reagenzien in einem bestimmten Temperaturbereich ermöglichen es Ihnen, die thermische Wirkung des Prozesses zu berechnen. Informationen über die Wärmekapazität von Lösungen ermöglichen die Berechnung ihrer thermodynamischen Parameter bei beliebigen Temperaturwerten innerhalb des analysierten Intervalls.
Zum Beispiel ist eine Flüssigkeit dadurch gekennzeichnet, dass sie einen Teil der Wärme aufwendet, um den Wert der potentiellen Energie zu ändernreagierende Moleküle. Dieser Wert wird als "Konfigurations"-Wärmekapazität bezeichnet und zur Beschreibung von Lösungen verwendet.
Es ist schwierig, vollwertige mathematische Berechnungen durchzuführen, ohne die thermodynamischen Eigenschaften einer Substanz, ihren Aggregatzustand, zu berücksichtigen. Deshalb wird für Flüssigkeiten, Gase, Feststoffe eine solche Eigenschaft wie die spezifische Wärmekapazität verwendet, die es ermöglicht, die Energieparameter eines Stoffes zu charakterisieren.






