Thermodynamik ist ein wichtiger Zweig der Physik. Wir können mit Sicherheit sagen, dass seine Errungenschaften zum Beginn des technologischen Zeit alters geführt und den Lauf der Menschheitsgeschichte in den letzten 300 Jahren weitgehend bestimmt haben. Der Artikel behandelt den ersten, zweiten und dritten Hauptsatz der Thermodynamik und ihre Anwendung in der Praxis.
Was ist Thermodynamik?
Bevor wir die Gesetze der Thermodynamik formulieren, wollen wir herausfinden, was dieser Abschnitt der Physik tut.
Das Wort "Thermodynamik" ist griechischen Ursprungs und bedeutet "Bewegung durch Wärme". Das heißt, dieser Zweig der Physik befasst sich mit der Untersuchung beliebiger Prozesse, bei denen thermische Energie in mechanische Bewegung umgewandelt wird und umgekehrt.
Die Grundgesetze der Thermodynamik wurden Mitte des 19. Jahrhunderts formuliert. Die Wissenschaft von "Bewegung und Wärme" betrachtet das Verh alten des gesamten Systems als Ganzes, untersucht die Änderung seiner makroskopischen Parameter - Temperatur, Druck und Volumen und achtet nicht auf seine mikroskopische Struktur. Darüber hinaus spielt der erste von ihnen eine grundlegende Rolle bei der Formulierung von GesetzenThermodynamik in der Physik. Es ist merkwürdig festzustellen, dass sie ausschließlich aus experimentellen Beobachtungen stammen.
Das Konzept eines thermodynamischen Systems

Es bedeutet jede Gruppe von Atomen, Molekülen oder anderen Elementen, die als Ganzes betrachtet werden. Alle drei Gesetze sind für das sogenannte thermodynamische System formuliert. Beispiele sind: die Erdatmosphäre, jeder lebende Organismus, das Gasgemisch in einem Verbrennungsmotor usw.
Alle Systeme in der Thermodynamik gehören zu einem von drei Typen:
- Öffnen. Sie tauschen sowohl Wärme als auch Materie mit der Umgebung aus. Wenn zum Beispiel Essen in einem Topf auf offenem Feuer gekocht wird, ist dies ein anschauliches Beispiel für ein offenes System, da der Topf Energie aus der äußeren Umgebung (Feuer) erhält, während er selbst Energie in Form von Wärme abstrahlt. und auch Wasser verdunstet daraus (Stoffwechsel).
- Geschlossen. In solchen Systemen findet kein Stoffaustausch mit der Umgebung statt, wohl aber ein Energieaustausch. Zurück zum vorherigen Fall: Wenn Sie den Wasserkocher mit einem Deckel abdecken, erh alten Sie ein geschlossenes System.
- Isoliert. Dies ist eine Art thermodynamisches System, das weder Materie noch Energie mit dem umgebenden Raum austauscht. Ein Beispiel wäre eine Thermoskanne mit heißem Tee.
Thermodynamische Temperatur

Dieser Begriff bedeutet die kinetische Energie der Teilchen, die die umgebenden Körper bilden, die die Geschwindigkeit widerspiegeltzufällige Bewegung von Partikeln. Je größer es ist, desto höher ist die Temperatur. Dementsprechend kühlen wir es ab, indem wir die kinetische Energie des Systems reduzieren.
Dieser Begriff bedeutet die kinetische Energie der Teilchen, die die umgebenden Körper bilden, die die Geschwindigkeit der chaotischen Bewegung der Teilchen widerspiegelt. Je größer es ist, desto höher ist die Temperatur. Dementsprechend kühlen wir es ab, indem wir die kinetische Energie des Systems reduzieren.
Thermodynamische Temperatur wird in SI (International System of Units) in Kelvin ausgedrückt (zu Ehren des britischen Wissenschaftlers William Kelvin, der diese Skala zuerst vorgeschlagen hat). Das Verständnis des ersten, zweiten und dritten Hauptsatzes der Thermodynamik ist ohne eine Definition der Temperatur unmöglich.
Eine Teilung von einem Grad auf der Kelvin-Skala entspricht auch einem Grad Celsius. Die Umrechnung zwischen diesen Einheiten erfolgt nach der Formel: TK =TC + 273, 15, wobei TK und TC - Temperaturen in Kelvin bzw. Grad Celsius.
Die Besonderheit der Kelvin-Skala ist, dass sie keine negativen Werte hat. Null darin (TC=-273, 15 oC) entspricht dem Zustand, in dem die thermische Bewegung der Teilchen des Systems vollständig fehlt, sie scheinen "eingefroren" zu sein.
Energieerh altung und 1. Hauptsatz der Thermodynamik

Im Jahr 1824 machte Nicolas Léonard Sadi Carnot, ein französischer Ingenieur und Physiker, einen kühnen Vorschlag, der nicht nur zur Entwicklung der Physik führte, sondern auch zu einem wichtigen Schritt in der Verbesserung der Technologie wurde. Seinelässt sich wie folgt formulieren: „Energie kann nicht erzeugt oder vernichtet werden, sie kann nur von einem Zustand in einen anderen überführt werden.“
Tatsächlich postuliert Sadi Carnots Satz das Energieerh altungsgesetz, das die Grundlage des 1 die thermisch und mechanisch sind."
Die mathematische Formel für den 1. Hauptsatz lautet wie folgt:
Q=ΔU + A, hier ist Q die von der Umgebung auf das System übertragene Wärmemenge, ΔU die Änderung der inneren Energie dieses Systems, A die vollkommene mechanische Arbeit.
Adiabatische Prozesse
Ein gutes Beispiel dafür ist die Bewegung von Luftmassen entlang von Berghängen. Solche Massen sind riesig (Kilometer oder mehr), und Luft ist ein ausgezeichneter Wärmeisolator. Die genannten Eigenschaften erlauben es uns, alle innerhalb kurzer Zeit ablaufenden Prozesse mit Luftmassen als adiabat zu betrachten. Wenn Luft einen Berghang hinaufsteigt, sinkt ihr Druck, sie dehnt sich aus, verrichtet also mechanische Arbeit und kühlt dadurch ab. Im Gegenteil, die Abwärtsbewegung der Luftmasse wird von einem Druckanstieg in ihr begleitet, sie komprimiert und wird dadurch sehr heiß.
Am Beispiel eines adiabatischen Prozesses lässt sich die Anwendung des Hauptsatzes der Thermodynamik, die im vorangegangenen Untertitel besprochen wurde, am einfachsten demonstrieren.
Nach der Definition findet dadurch kein Energieaustausch mit stattUmgebung, dh in obiger Gleichung ist Q=0. Dies führt zu folgendem Ausdruck: ΔU=-A. Das Minuszeichen bedeutet hier, dass das System mechanische Arbeit verrichtet, indem es seine eigene innere Energie abbaut. Es sei daran erinnert, dass die innere Energie direkt von der Temperatur des Systems abhängt.
Richtung thermischer Prozesse
Diese Ausgabe befasst sich mit dem 2. Hauptsatz der Thermodynamik. Sicherlich ist jedem aufgefallen, dass, wenn man zwei Gegenstände mit unterschiedlichen Temperaturen in Kontakt bringt, sich der k alte immer aufheizt und der heiße abkühlt. Beachten Sie, dass der umgekehrte Prozess im Rahmen des ersten Hauptsatzes der Thermodynamik auftreten kann, aber niemals in die Praxis umgesetzt wird.
Der Grund für die Irreversibilität dieses Prozesses (und aller bekannten Prozesse im Universum) ist der Übergang des Systems in einen wahrscheinlicheren Zustand. Im betrachteten Beispiel mit dem Kontakt zweier Körper unterschiedlicher Temperatur wird der wahrscheinlichste Zustand derjenige sein, in dem alle Teilchen des Systems die gleiche kinetische Energie haben.
Der zweite Hauptsatz der Thermodynamik lässt sich wie folgt formulieren: "Wärme kann niemals spontan von einem k alten Körper auf einen heißen übertragen werden." Führen wir den Begriff der Entropie als Maß für die Unordnung ein, so lässt sich dieser wie folgt darstellen: „Jeder thermodynamische Prozess läuft mit einer Zunahme der Entropie ab.“
Wärmekraftmaschine

Unter diesem Begriff versteht man ein System, das durch Zufuhr von äußerer Energie mechanische Arbeit verrichten kann. ZuerstWärmekraftmaschinen waren Dampfmaschinen und wurden Ende des 17. Jahrhunderts erfunden.
Der zweite Hauptsatz der Thermodynamik spielt eine entscheidende Rolle bei der Bestimmung ihrer Wirksamkeit. Sadi Carnot stellte auch fest, dass die maximale Effizienz dieses Geräts ist: Effizienz=(T2 - T1)/T2, hier T2 und T1 sind Heizungs- und Kühlschranktemperaturen. Mechanische Arbeit kann nur verrichtet werden, wenn Wärme von einem heißen Körper zu einem k alten fließt und dieser Strom nicht zu 100 % in nutzbare Energie umgewandelt werden kann.
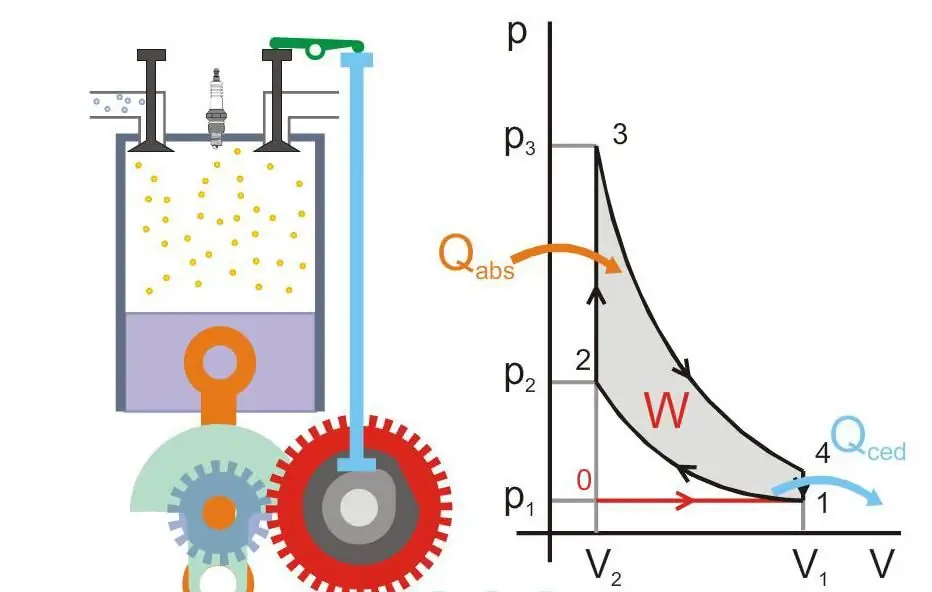
Die folgende Abbildung zeigt das Funktionsprinzip einer Wärmekraftmaschine (Qabs - auf die Maschine übertragene Wärme, Qced - Wärmeverlust, W - Nutzarbeit, P und V - Druck und Gasvolumen im Kolben).
Absoluter Nullpunkt und Nernstsches Postulat
Abschließend kommen wir zur Betrachtung des dritten Hauptsatzes der Thermodynamik. Es wird auch Nernst-Postulat genannt (der Name des deutschen Physikers, der es Anfang des 20. Jahrhunderts erstmals formulierte). Das Gesetz sagt: "Der absolute Nullpunkt kann nicht mit endlich vielen Prozessen erreicht werden." Das heißt, es ist in keiner Weise möglich, die Moleküle und Atome einer Substanz vollständig "einzufrieren". Grund dafür ist der ständig vorhandene Wärmeaustausch mit der Umgebung.

Eine nützliche Schlussfolgerung aus dem dritten Hauptsatz der Thermodynamik ist, dass die Entropie abnimmt, wenn man sich dem absoluten Nullpunkt nähert. Das bedeutet, dass das System dazu neigt, sich selbst zu organisieren. Diese Tatsache kannB. um Paramagnete beim Abkühlen in einen ferromagnetischen Zustand zu überführen.
Interessanterweise liegt die niedrigste bisher erreichte Temperatur bei 5·10−10 K (2003, MIT Laboratory, USA).






