Der adiabatische Übergang zwischen zwei Zuständen in Gasen gehört nicht zu den Isoprozessen, spielt jedoch nicht nur in verschiedenen technologischen Prozessen, sondern auch in der Natur eine wichtige Rolle. In diesem Artikel werden wir betrachten, was dieser Prozess ist, und auch die adiabatischen Gleichungen für ein ideales Gas angeben.
Das ideale Gas in Kürze
Ein ideales Gas ist eines, in dem es keine Wechselwirkungen zwischen seinen Teilchen gibt und ihre Größe gleich Null ist. In der Natur gibt es natürlich keine hundertprozentig idealen Gase, da sie alle aus Molekülen und Atomen der Größe bestehen, die immer zumindest mit Hilfe von Van-der-Waals-Kräften miteinander wechselwirken. Dennoch wird das beschriebene Modell oft mit ausreichender Genauigkeit zur Lösung praktischer Probleme für viele reale Gase durchgeführt.
Die Hauptgleichung eines idealen Gases ist das Clapeyron-Mendeleev-Gesetz. Es wird in der folgenden Form geschrieben:
PV=nRT.
Diese Gleichung stellt eine direkte Proportionalität zwischen dem Produkt herDruck P vom Volumen V und die Stoffmenge n von der absoluten Temperatur T. Der Wert von R ist die Gaskonstante, die die Rolle eines Proportionalitätsfaktors spielt.
Was ist ein adiabatischer Prozess?
Ein adiabatischer Prozess ist ein Übergang zwischen den Zuständen eines Gassystems, bei dem kein Energieaustausch mit der Umgebung stattfindet. In diesem Fall ändern sich alle drei thermodynamischen Kenngrößen des Systems (P, V, T) und die Stoffmenge n bleibt konstant.
Unterscheide zwischen adiabatischer Expansion und Kontraktion. Beide Prozesse finden nur aufgrund der inneren Energie des Systems statt. Durch die Ausdehnung sinken also der Druck und vor allem die Temperatur des Systems dramatisch. Umgekehrt führt die adiabatische Kompression zu einem positiven Temperatur- und Drucksprung.
Um einen Wärmeaustausch zwischen Umgebung und Anlage zu verhindern, muss diese wärmegedämmte Wände haben. Darüber hinaus reduziert die Verkürzung der Prozesszeit den Wärmefluss zum und vom System erheblich.
Poisson-Gleichungen für einen adiabatischen Prozess

Der erste Hauptsatz der Thermodynamik wird wie folgt geschrieben:
Q=ΔU + A.
Mit anderen Worten, die dem System zugeführte Wärme Q wird verwendet, um Arbeit A des Systems zu verrichten und seine innere Energie ΔU zu erhöhen. Um die adiabatische Gleichung zu schreiben, sollte man Q=0 setzen, was der Definition des untersuchten Prozesses entspricht. Wir erh alten:
ΔU=-A.
Mit IsochorieProzess in einem idealen Gas, die gesamte Wärme wird verwendet, um die innere Energie zu erhöhen. Diese Tatsache erlaubt es uns, die Gleichheit zu schreiben:
ΔU=CVΔT.
wobei CV die isochore Wärmekapazität ist. Arbeit A wiederum berechnet sich wie folgt:
A=PdV.
Wobei dV eine kleine Lautstärkeänderung ist.
Zusätzlich zur Clapeyron-Mendeleev-Gleichung gilt für ein ideales Gas die folgende Gleichung:
CP- CV=R.
Wobei CP die isobare Wärmekapazität ist, die immer größer ist als die isochore, da sie Gasverluste durch Ausdehnung berücksichtigt.
Durch Analysieren der oben geschriebenen Gleichungen und Integrieren über Temperatur und Volumen erh alten wir die folgende adiabatische Gleichung:
TVγ-1=const.
Hier ist γ der adiabatische Index. Sie ist gleich dem Verhältnis der isobaren Wärmekapazität zur isochoren. Diese Gleichheit wird als Poisson-Gleichung für einen adiabatischen Prozess bezeichnet. Wenn Sie das Clapeyron-Mendeleev-Gesetz anwenden, können Sie zwei weitere ähnliche Ausdrücke schreiben, nur über die Parameter P-T und P-V:
TPγ/(γ-1)=const;
PVγ=const.
Adiabatischer Graph kann in verschiedenen Achsen angegeben werden. Unten ist es in P-V-Achsen dargestellt.
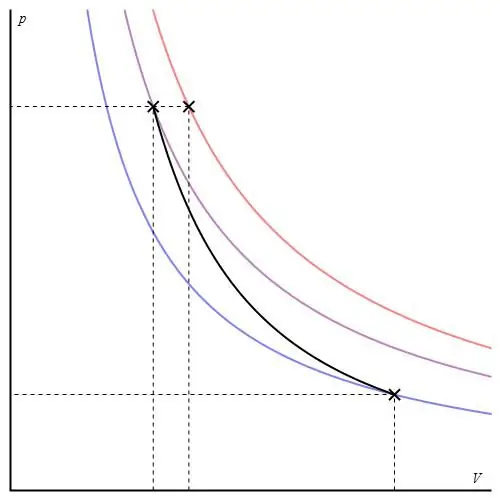
Farbige Linien in der Grafik entsprechen Isothermen, die schwarze Kurve ist ein Adiabat. Wie man sieht, verhält sich der Adiabat schärfer als jede der Isothermen. Dieser Umstand ist einfach zu erklären: Bei der Isotherme ändert sich der Druck zurückproportional zum Volumen, aber für das Isobad ändert sich der Druck schneller, da der Exponent für jedes Gassystem γ>1 ist.
Beispielaufgabe
In der Natur, in Berggebieten, wenn die Luftmasse den Hang hinaufsteigt, sinkt ihr Druck, sie nimmt an Volumen zu und kühlt ab. Dieser adiabatische Prozess senkt den Taupunkt und erzeugt flüssige und feste Niederschläge.

Es wird vorgeschlagen, das folgende Problem zu lösen: Beim Anheben der Luftmasse entlang des Berghangs fiel der Druck um 30% im Vergleich zum Druck am Fuß. Wie hoch war seine Temperatur, wenn er am Fuß 25 oC betrug?
Um das Problem zu lösen, verwenden Sie die folgende adiabatische Gleichung:
TPγ/(γ-1)=const.
Schreiben Sie es besser in dieser Form:
T2/T1=(P2/P 1)(γ-1)/γ.
Wenn P1 als 1 Atmosphäre genommen wird, dann entspricht P2 0,7 Atmosphären. Für Luft beträgt der adiabatische Index 1,4, da es als zweiatomiges ideales Gas betrachtet werden kann. Der Temperaturwert von T1 ist 298,15 K. Wenn wir alle diese Zahlen in den obigen Ausdruck einsetzen, erh alten wir T2=269,26 K, was entspricht - 3, 9 oC.






